I 5 PILLAR
PER IL SUCCESSO A LUNGO TERMINE1
I pilastri del successo a lungo termine della ART:1
Caratteristiche farmacologiche1
Potenza, barriera genetica e forgiveness del regime sono i tre principali determinanti farmacologici del successo a lungo termine1
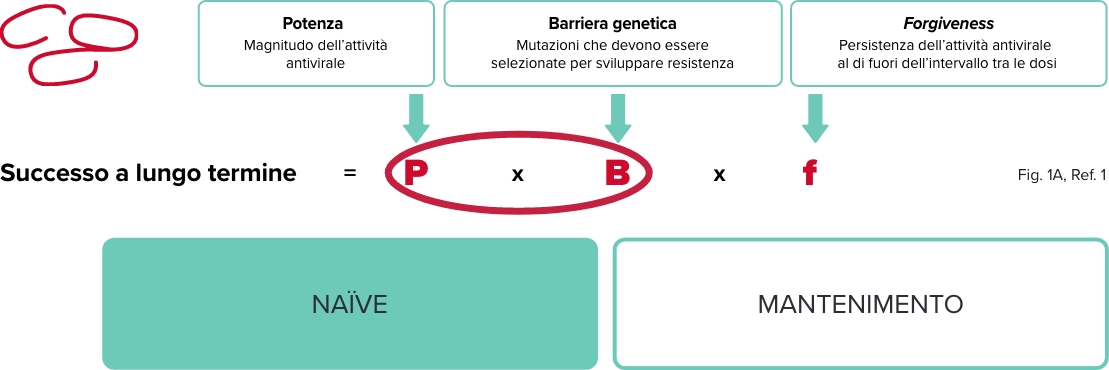
POTENZA E BARRIERA GENETICA DI BIKTARVY®
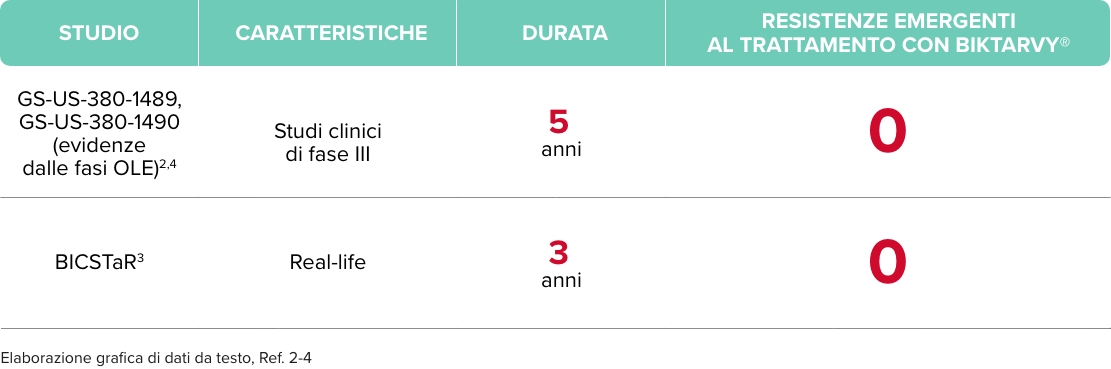
BIKTARVY®: efficacia dimostrata fino a 5 anni e dati di resistenza a 3 e a 5 anni2,3


Potenza, barriera genetica e forgiveness del regime sono i tre principali determinanti farmacologici del successo a lungo termine1
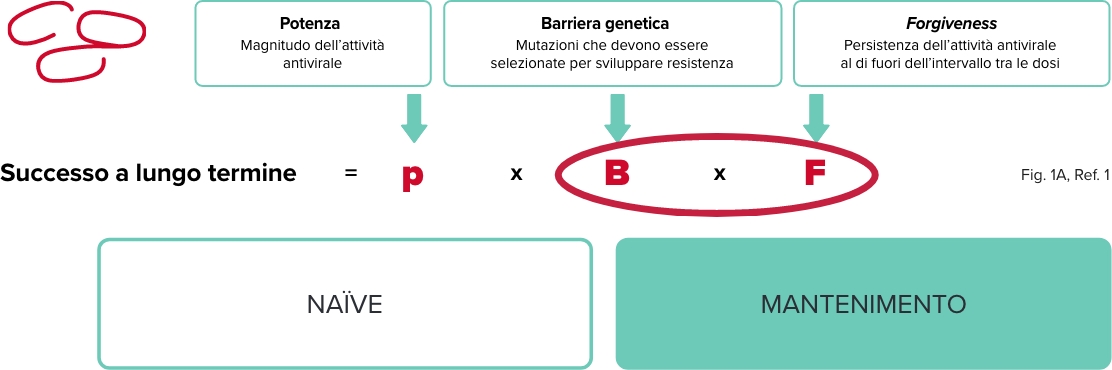
BARRIERA GENETICA

BIKTARVY®: elevata barriera genetica mantenuta nel tempo negli studi clinici e in real-world di switch2
FORGIVENESS

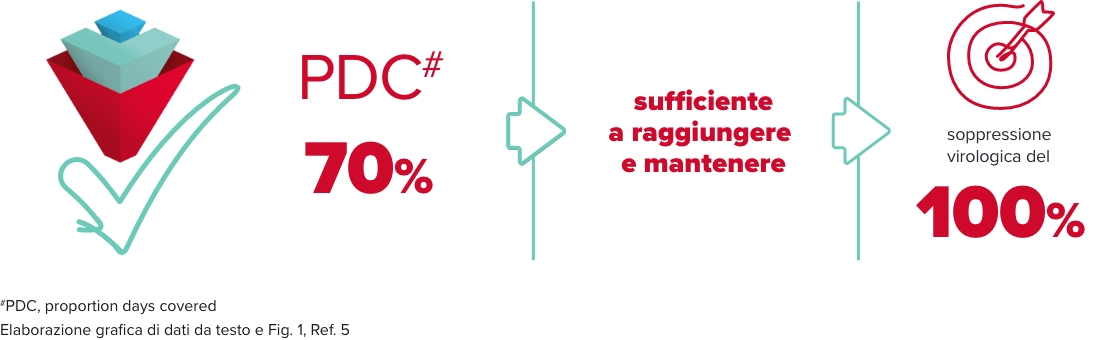
BIKTARVY®: elevata forgiveness5#
In una popolazione con un’aderenza mediana del 98% al trattamento con BIKTARVY®, un’aderenza fino al 70% è risultata essere sufficiente, nello studio clinico analizzato, per ottenere e mantenere il 100% di soppressione virologica5
Bibliografia
- Taramasso L et al. Pillars of long-term antiretroviral therapy success. Pharmacol Res 2023:196:106898.
- Sax PE et al. Bictegravir/emtricitabine/tenofovir alafenamide as initial treatment for HIV-1: five-year follow-up from two randomized trials. EClinicalMedicine 2023:59:101991.
- Sabranski M et al. Bictegravir/emtricitabine/tenofovir alafenamide (B/F/TAF) in antiretroviral treatment-naïve (TN) and -experienced (TE) people with HIV (PWH): 3-year effectiveness and safety outcomes in the BICSTaR observational cohort. Abstract 291. HIV Med 2023;24(Suppl. 5):3-675.
- Orkin C, et al. Switch to bictegravir/emtricitabine/tenofovir alafenamide from dolutegravir-based therapy: 96-week pooled analysis. AIDS. 2024 Feb 12. doi: 10.1097/QAD.0000000000003865. Epub ahead of print.
- Maggiolo F et al. Real World Data on Forgiveness to Uncomplete Adherence to Bictegravir/Emtricitabine/Tenofovir Alafenamide. J Int Assoc Provid AIDS Care 2022;21:23259582221140208.
*La sicurezza e l’efficacia di BIKTARVY® come terapia iniziale sono state
stabilite in due studi di fase 3,
randomizzati, in doppio cieco, verso controllo attivo: studio 1489 (rispetto a
DTG/ABC/3TC) e studio 1490 (rispetto a DTG + FTC/TAF). Entrambi gli studi hanno dimostrato che
BIKTARVY® non è
inferiore
ai regimi basati su DTG, con alti tassi di soppressione
virologica e nessuna resistenza emergente al trattamento per 144 settimane. Dopo 144 settimane
di follow-up
randomizzato, un’estensione in aperto ha valutato BIKTARVY® a 240
settimane. Dei 634 partecipanti randomizzati a BIKTARVY®, 519 hanno completato il trattamento in
doppio cieco e
506/634
(80%) hanno partecipato all’estensione in aperto di 96
settimane, che è stata completata da 444/506 (88%) partecipanti. L’efficacia era basata
sull’outcome secondario
della
percentuale di partecipanti con HIV-1 RNA <50 copie/mL a 240 settimane (utilizzando i metodi
missing = excluded e
missing = failure).2
‡Tra i pazienti con dati virologici disponibili, il 98,6% (IC 95% [97,0%-99,5%], 426/432)
ha mantenuto HIV-1 RNA
<50 copie/mL alla settimana 240 (missing = excluded); quando i dati virologici mancanti sono
stati considerati
un fallimento, il 67,2% (IC 95% [63,4%-70,8%], 426/634) ha mantenuto l’HIV-1 RNA <50
copie/mL.2
†L’efficacia a 3 anni nello studio BICSTaR è stata alta (missing data =
excluded, discontinuation =
failure), 97% e 76% dei pazienti TN e 97% e 78% dei pazienti TE con tassi simili osservati nei
gruppi chiave. In questo
studio osservazionale, in real-world, ancora in corso, BIKTARVY® è stato associato ad
alti livelli di
efficacia a 3 anni in tutti gruppi, senza
resistenze emergenti al trattamento e nessun
nuovo o inaspettato
risultato di sicurezza.3
§781 (122 TN/659 TE) PWH sono state incluse dallo studio principale, di cui 449
(67 TN/382
TE) hanno consentito di
partecipare all’estensione. Tra i partecipanti TE, il 68%/18%/14%
è passato da
regimi basati su
INSTI/NNRTI/PI e il 50%/34%/14% da regimi basati su TAF/TDF/ABC, rispettivamente.3
#Studio Maggiolo et al. Studio retrospettivo che ha incluso tutte le PWH di questa
coorte trattate con BIKTARVY® da
gennaio 2020 a marzo 2022. Sono stati inclusi i pazienti con un
minimo di 2 ritiri di farmaco (ricariche), indipendentemente dalla durata del loro follow-up. La
PDC (numero di giorni
con farmaco disponibile diviso il numero di giorni in uno specifico
intervallo di tempo) è stata utilizzata come indicatore dell’aderenza. Al fine di categorizzare
i pazienti in termini di
riposta virologica, sono stati utilizzati tre diversi cut-off virologici:
È stato applicato un modello probit per verificare l’impatto delle variabili
basali e dell’aderenza sugli outcome
virologici dicotomicamente definiti in accordo ai cut-off
precedentemente descritti.5 In questa analisi retrospettiva un totale di 281 PWH
è stato
trattato con BIKTARVY® e ha
soddisfatto i criteri di inclusione dello studio. L’età mediana della
coorte era di 49 anni (IQR: 43-58 anni) e la durata mediana di infezione da HIV è stata di 8
anni (IQR: 5-16 anni) a
indicare che la maggior parte dei pazienti arruolati erano PWH che
sono passati a BIKTARVY® da regimi ART precedenti. Il follow-up mediano della coorte è stato
di
590 giorni (IQR:
381-685), per un totale di 343 pazienti/anno di follow-up.5
Materiale di informazione medico-scientifica destinato ai medici infettivologi/farmacisti
ospedalieri con inserito il
Riassunto delle Caratteristiche del Prodotto comprensivo
delle informazioni relative alla classe, al prezzo e al regime di dispensazione. Vietata la
distribuzione o esposizione
al pubblico.
Depositato presso AIFA in data 22/03/2024 - Codice AIFA HIV2409
